Скачать с ютуб #17 chemia- wiązania kowalencyjne, elektroujemność, dipole, polarność в хорошем качестве
Скачать бесплатно и смотреть ютуб-видео без блокировок #17 chemia- wiązania kowalencyjne, elektroujemność, dipole, polarność в качестве 4к (2к / 1080p)
У нас вы можете посмотреть бесплатно #17 chemia- wiązania kowalencyjne, elektroujemność, dipole, polarność или скачать в максимальном доступном качестве, которое было загружено на ютуб. Для скачивания выберите вариант из формы ниже:
Загрузить музыку / рингтон #17 chemia- wiązania kowalencyjne, elektroujemność, dipole, polarność в формате MP3:
Если кнопки скачивания не
загрузились
НАЖМИТЕ ЗДЕСЬ или обновите страницу
Если возникают проблемы со скачиванием, пожалуйста напишите в поддержку по адресу внизу
страницы.
Спасибо за использование сервиса savevideohd.ru
#17 chemia- wiązania kowalencyjne, elektroujemność, dipole, polarność
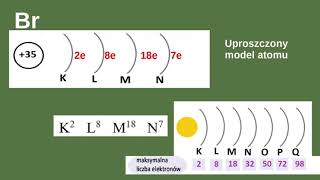
Link do mojego konta na Instagramie: / rozycka_gabrysia Link do filmiku: • #16 chemia- ZADANIA spod 19. tematu, ... Temat: Wiązanie kowalencyjne. • Atomy pierwiastków chemicznych mogą łączyć się ze sobą wiązaniami chemicznymi, tworząc cząsteczki. • W tworzeniu wiązań chemicznych najważniejszą rolę odgrywają elektrony walencyjne (przedstawiamy je kropkami) • Atomy dążą do uzyskania konfiguracji elektronowej najbliższego gazu szlachetnego. Dążą do tego, żeby mieć 8 elektronów walencyjnych, czyli osiągnąć oktet elektronowy. Wyjątkiem jest wodór, który dąży do uzyskania konfiguracji elektronowej helu, czyli dubletu elektronowego (2 elektrony). Atomy mają wtedy trwały stan elektronowy. • Takie małe wtrącenie ode mnie: tutaj macie zebraną teorię, wytłumaczenie macie w filmiku, dlatego koniecznie obejrzyjcie! :D • Gazy szlachetne mają trwały stan elektronowy, więc nie reagują z innymi atomami. • Wiązania kowalencyjne to wiązania chemiczne między atomami, które powstają w wyniku utworzenia wspólnej pary elektronowej. Tworzenie się tych wiązań macie na filmiku! • Wiązanie kowalencyjne utworzone za pomocą jednej wspólnej pary elektronowej nazywamy wiązaniem pojedynczym. • Wiązanie kowalencyjne można przedstawić za pomocą kreski łączącej atomy. Jedna kreska oznacza 2 elektrony, a elektrony możemy też zapisywać jako kropki i wtedy jedna kropka = jeden elektron. • Pierwiastki chemiczne zapisuje się symbolami chemicznymi, a do zapisu cząsteczek używamy wzorów chemicznych. • Liczba umieszczana w indeksie dolnym informuje nas o liczbie atomów pierwiastka chemicznego, które tworzą tę cząsteczkę. • W postaci cząsteczki dwuatomowej występuje wodór, azot, tlen, fluor, chlor, brom i jod, a w postaci cząsteczek wieloatomowych siarka, fosfor i selen. • Elektroujemność jest to zdolność atomu danego pierwiastka do przyciągania elektronów tworzących wiązanie chemiczne. Podajemy ją w liczbach od 0,7-4. Skalę tą nazywamy skalą Paulinga. Niską elektroujemność mają pierwiastki metaliczne (najmniejszą-cez i frans), a wysoką metale (największą- fluor). Elektroujemność macie w układach okresowych na czerwono. • Rodzaj powstającego wiązania chemicznego zależy od różnicy elektroujemności pierwiastków, które są połączone. • W wiązaniach kowalencyjnych różnica elektroujemności jest mniejsza od 1,7. • W cząsteczkach, które tworzą takie same pierwiastki różnica elektroujemności = 0, się para elektronów jest w równej odległości od obydwu atomów. Takie wiązanie to wiązanie kowalencyjne niespolaryzowane. • Jeśli atomy w cząsteczce mają różną elektroujemność, to jeden z nich, ten o większej elektroujemności silniej przyciąga parę elektronów, więc w jego obrębie występuje biegun ujemny, a przy tym drugim- dodatni. Wiązanie to nazywamy kowalencyjnym spolaryzowanym, a cząsteczki z dwoma biegunami (ujemnym i dodatnim) dipolami. Dipolem jest np. woda. • Zjawisko przesuwania się wspólnej pary elektronowej w stronę jednego z atomów nosi nazwę polaryzacji wiązania chemicznego. Do usłyszenia Misie!





![Wiązania chemiczne, elektroujemność #1 [ Tworzenie związków chemicznych ]](https://i.ytimg.com/vi/6gDkTPiiKXE/mqdefault.jpg)
![Wiązania jonowe #3 [ Tworzenie związków chemicznych ]](https://i.ytimg.com/vi/ScPiQZ8Xhns/mqdefault.jpg)

